[mybigtext]Человек многое заимствует у природы. Ласты в свое время были скопированы с перепончатых лап водоплавающих птиц, рубка деревьев ударами под углом взята у бобров, а приборы ночного видения вдохновлены устройством глаз змей. Такие природные технологии восхищают своей сложностью и при этом изящной простой. А что насчет микромира? Идея заимствовать что-то у бактерий и микроорганизмом казалась сомнительной еще 20 лет назад, сейчас на этом основана одна из самых перспективных технологий генной терапии — CRISPR/Cas9. О нем пишут в новостях, но что это и как работает — знают немногие. Так давайте разберемся.[/mybigtext]
Что значат эти буквы
Непосвященного человека в ступор ставит уже название технологии: CRISPR/Cas9. Выглядит, как длинная аббревиатура, набор букв или в крайнем случае инвентарный номер.
На самом деле, в этом названии практически исчерпывающе зашифрован принцип действия революционного метода.
[simple_tooltip content=’читается как «криспер»’]CRISPR[/simple_tooltip] — Clustered Regularly Interspaced Short Palindromic Repeat, то есть, по-русски, короткие палиндромные кластерные повторы. Мягко говоря, малопонятное словосочетание, но, как будет видно дальше, оно скрывает в себе центральный элемент всей технологии.
А Cas9 — это название белка, который умеет разрушать вредоносную ДНК, то есть он — главный «боец».
История открытия и принцип работы
Среди всех заболеваний одна из самых проблематичных групп — наследственные болезни. Попытки и подходы к лечению генетических дефектов предпринимались раньше, но без особого успеха. Среди наследственных болезней есть группа генных заболеваний. Их причина кроется очень глубоко — на уровне генетического кода человека. Классический пример — гемофилия у последнего царевича Алексея Романова, которая передалась ему от бабушки. В ходе мутации была затронута не ядерная структура ДНК (такое бывает, например, при муковисцидозе), а хромосома, но суть остается прежней — такие болезни считались неизлечимыми.
Вариант тут только один — исправить генетическую структуру человека вручную. Но как? На помощь пришли бактерии.
Все началось в конце 80-х, когда японские ученые [simple_tooltip content=’расшифровали’]секвенсировали[/simple_tooltip] геном кишечной палочки. Их заинтересовал участок, в котором был набор повторяющихся последовательностей ДНК, разделенных различными участками-спейсерами. Специалистов привлек тот факт, что этот участок не кодировал ровным счетом ничего.
В 1960-х для тех последовательностей ДНК, которые не кодируют белков, ввели обидное, а как оказалось, и далеко не точное название — «мусорная ДНК». Дело в том, что большое количество [simple_tooltip content=’место гена’]локусов[/simple_tooltip] в геноме неизбежно ведёт к снижению приспособленности, а следовательно — к вымиранию. Японский ученый Сусуму Оно даже назвал точный предел объема генома для млекопитающих — 30000 локусов, и был прав: у человека, например, их всего 20000.
Все сказанное выше справедливо и для бактерий: лишние участки ДНК, которые ничего не кодируют, не нужны, как считалось раньше. А бактерии, в силу, в принципе, небольшого генома, относятся к своим локусам особо экономно. Значит последовательность зачем-то нужна бактерии?
Потом такие повторяющиеся цепочки кассет и спейсеров нашли у других бактерий, и стало понятно, что тут точно действует какой-то механизм, а не случайная мутация. Название CRISPR — «короткие палиндромные кластерные повторы» — точно описывает суть явления. Они и правда короткие: те участки, которые разделены спейсерами, повторяются, а по своей структуре эти «повторы» симметричны — читаются одинаково в обе стороны. В русском языке предложения типа «А роза упала на лапу Азора» читаются одинаково в обе стороны и называются палиндромами, вот и генетика решила позаимствовать этот термин.
Бактериальный иммунитет и йогурт
Итак, у нас были бактерии с CRISPR и не было понимания, для чего он нужен. Тем не менее информация о повторяющихся некодирующих участках копилась, и по их виду даже начали классифицировать микроорганизмы. Это стало удобным способом для защиты авторских прав на бактерии в кисломолочной промышленности: компания Danisco с помощью типирования своих штаммов по виду их CRISPR легко смогла выигрывать суды у тех, кто пользовался их патентами. Сами не зная того, Danisco внесли вклад в борьбу с болезнями, на след которых мы могли не напасть еще долго.
[mydoubleline]Danisco — датская пищевая компания, которая, помимо всего прочего, занимается производством пищевых заквасок. У компании внушительный пакет патентов — около 9300 штук.[/mydoubleline]
У Danisco была вполне практическая цель — заполучить бактерии, устойчивые к вирусам. Дело в том, что ферментация в промышленных масштабах происходит в огромных чанах с молоком, куда добавляют молочнокислые бактерии. Но если в [simple_tooltip content=’тот самый чан’]ферментер[/simple_tooltip] попадет вирус-бактериофаг, то ферментация нарушится, и будут убытки. Нужны устойчивые образцы. Как их заполучить? А просто: отобрать в лабораторных условиях такие бактерии, которые могут расти в присутствии вируса.
Danisco выращивала вирусостойкие бактерии и раньше, но до прорыва оставался один шаг. Случился он, когда специалисты обнаружили, что у устойчивых бактерий в последовательности CRISPR появились спейсеры, которые идентичны геному вируса. Последовал эксперимент, и организмам в CRISPR вживили кассеты генома вируса. В результате чего бактерии стали вирусостойкими. CRISPR освободился от звания «мусорной ДНК» — его истинная суть состояла в том, чтобы копировать участки вируса, выполняя роль иммунной системы.
Cas9: ДНК-скальпель
Еще до изысканий Danisco о защитных свойствах CRISPR говорил биоинформатик Евгений Кунин, который предложил детальную модель работы иммунной системы бактерий. По его мнению, бактерия, пережившая атаку вируса, копировала часть его генома, записывая новые блоки в последовательность CRISPR. Кунин обратил внимание на то, что рядом с CRISPR-кассетами часто располагается белок Cas. Он предположил, что Cas обнаруживает вирус по РНК-копии, синтезированной с CRISPR, а когда обнаруживает, то расщепляет его. Говоря проще, Cas — полицейский, CRISPR — база данных, РНК-копия — фоторобот или ориентировка, а вирус — преступник-рецидивист, который решил повторить своё злодеяние. Своё исследование Кунин опубликовал в ряде научных журналов, но фурора не вызвал. Теперь, после исследования Danisco и исследований, параллельных ему, был собран реальный фактический материал, и научное сообщество зашевелилось.
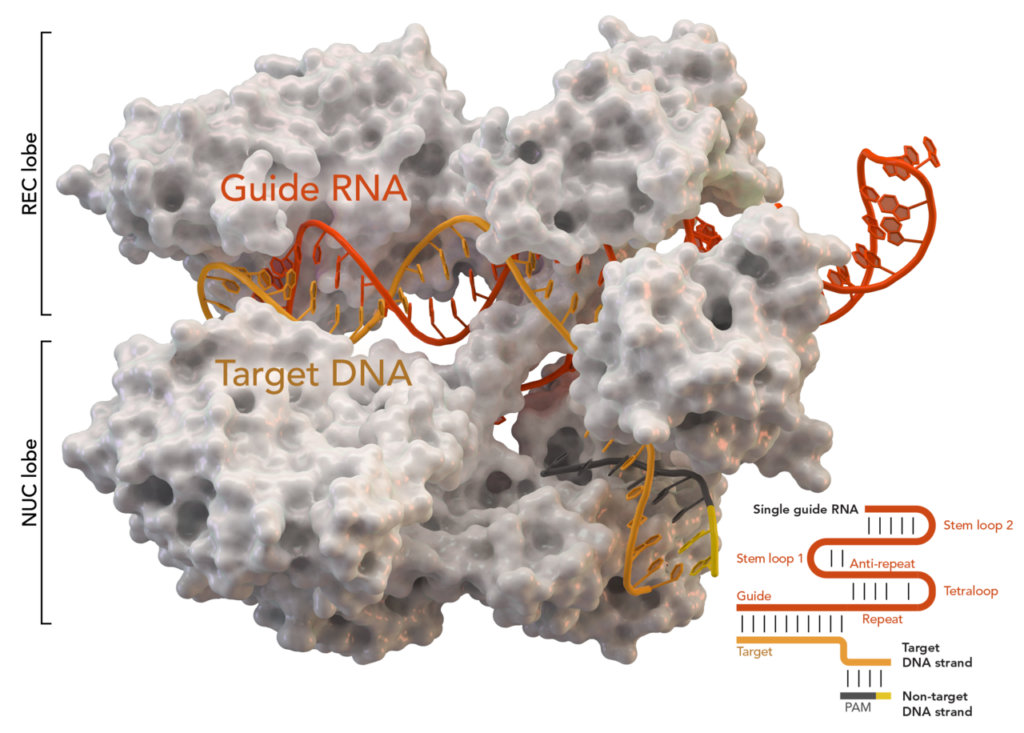
Еще один шаг в нужную сторону сделала Эммануэль Шарпентье, которая нашла тот самый девятый Cas. В прочих системах CRISPR, которые кодируют белки Cas, действовала целая система, если хотите — отдел полиции. Один белок обнаруживает вирус, другой синтезирует РНК, третий кусает. А Шарпентье нашла такой участок, который кодирует всего один белок, и он делает все сам. И если прочие системы были отделами полиции, то Cas9 — Раст Коул, который борет злодея в одиночку, да простит меня персонаж Вуди Харрельсона.
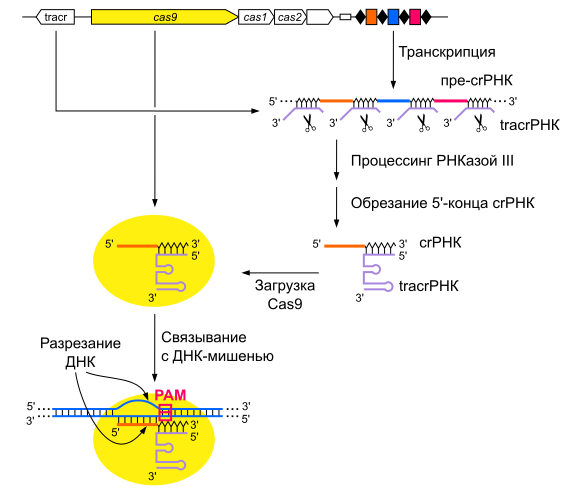
Дальше — больше, и специалистами была предложена схема, при которой РНК CRISPR кодируется не природными кассетами, которые содержит геном бактерии, а с помощью управляемой человеком ферментации. То есть белок Cas9 уже работал не по наводке природной РНК, а по той схеме, которую выбирал человек. И если запрограммировать CRISPR так, как надо нам, он в теории может разрезать мутировавший ген, отвечающий за болезнь.
Комплекс CRISPR/Cas9
От теоретических выкладок и экспериментов пищевых компаний CRISPR/Cas9 прошел путь до одной из самых востребованных технологий в генной терапии. Но основная битва у нас еще впереди. Технологии предстоит обрасти деталями и научиться сверхточному действию, прежде чем мы сможем победить генетические заболевания.
В идеале все выглядит так: больному, скажем, гемофилией, вводят бактерии с CRISPR, кодированным правильным образом. Cas9, пользуясь синтетической РНК, обнаруживает зараженные участки и разрезает их. Затем мы заменяем разрезанные участки на здоровую ДНК. Или она сама восстанавливается, используя схемы из здоровой парной хромосомы.
В отдаленном будущем, когда будут прояснены детали всей процедуры, мы сможем лечить таким образом муковисцидоз, гемофилию и еще некоторые подобные заболевания. Для больных лейкемией еще потребуется химиотерапия, чтобы убить зараженные клетки, но в целом все относительно просто с такими болезнями, у которых есть четкая зависимость от конкретных участков ДНК.
Сложность возникает с заболеваниями, к которым пока не могут найти четких участков генома. В их числе алкоголизм и шизофрения: у них есть явная генетическая база, но исследования постоянно опровергают друг друга, предлагая разные участки генома в качестве ответственного за недуг. У таких болезней непонятно, что нужно резать и как кодировать CRISPR.
Практического применения у технологии пока немного — нужно тщательно изучить детали, обезопасить пациента и повысить эффективность. Но есть и хорошие новости: например, в Китае с помощью CRISPR/Cas9 вылечили около 10% эмбрионов с болезнью крови [simple_tooltip content=’заболевание, при котором снижается синтез полипептидных цепей, входящих в структуру нормального гемоглобина’]бета-талассемией[/simple_tooltip]. Кстати, болезни крови — первая мишень для CRISPR/Cas9, в них достаточно исправить генетический дефект кроветворной системы. А с этим вполне можно справиться.
Послесловие
Безусловно, CRISPR/Cas9 «хайпанул» в мире науки. О нем теперь знают многие, и многие возлагают надежды на то, что он поборет ранее неизлечимые болезни. Пока идут споры и пишутся статьи, ученые дорабатывают технологию, узнают, что она может и чего не сможет никогда. Хотелось бы верить, что за теоретическим прорывом будет прорыв практический, и поколение второй половины XXI века не будет знать о лейкемии и гемофилии, как мы не знаем о чуме и оспе благодаря прививкам. Будущее покажет.


